- Autor Alex Aldridge [email protected].
- Public 2023-12-17 13:47.
- Ostatnio zmodyfikowany 2025-06-01 07:37.
Kluczowa różnica między reakcjami pierwszego i drugiego rzędu polega na tym, że szybkość reakcji pierwszego rzędu zależy od pierwszej potęgi stężenia reagenta w równaniu szybkości, podczas gdy szybkość reakcji drugiego rzędu zależy od drugiej potęgi stężenia wyraz w równaniu stawki.
Kolejność reakcji jest sumą potęg, do których wzrastają stężenia reagentów w równaniu kinetycznym. Zgodnie z tą definicją istnieje kilka form reakcji; reakcje zerowego rzędu (reakcje te nie zależą od stężenia reagentów), reakcje pierwszego rzędu i reakcje drugiego rzędu.
Co to są reakcje pierwszego rzędu?
Reakcje pierwszego rzędu to reakcje chemiczne, których szybkość zależy od stężenia molowego jednego z reagentów biorących udział w reakcji. Dlatego też, zgodnie z powyższą definicją, dla kolejności reakcji, suma potęg, do których wzrastają stężenia reagentów w równaniu kinetycznym zawsze będzie równa 1. W tych reakcjach może brać udział jeden reagent. Następnie stężenie tego reagenta określa szybkość reakcji. Ale czasami w tych reakcjach bierze udział więcej niż jeden reagent, wtedy jeden z tych reagentów określi szybkość reakcji.
Rozważmy przykład, aby zrozumieć tę koncepcję. W reakcji rozkładu N2O5 tworzy NO2 i O 2 gazy jako produkty. Ponieważ ma tylko jeden reagent, możemy zapisać reakcję i równanie szybkości w następujący sposób.
2N2O5(g) → 4NO2(g) + O 2(g)
Stawka=k[N2O5(g)]m
Tutaj k jest stałą szybkości dla tej reakcji, a m jest rzędem reakcji. Dlatego z oznaczeń eksperymentalnych wartość m wynosi 1. Zatem jest to reakcja pierwszego rzędu.
Co to są reakcje drugiego rzędu?
Reakcje drugiego rzędu to reakcje chemiczne, których szybkość zależy od stężenia molowego dwóch reagentów lub drugiej potęgi jednego reagenta biorącego udział w reakcji. Dlatego też, zgodnie z powyższą definicją kolejności reakcji, suma potęg, do których podniesione są stężenia reagentów w równaniu kinetycznym, będzie zawsze równa 2. Jeśli są dwa reagenty, tempo reakcji będzie zależeć od pierwszej potęgi stężenia każdego reagenta.
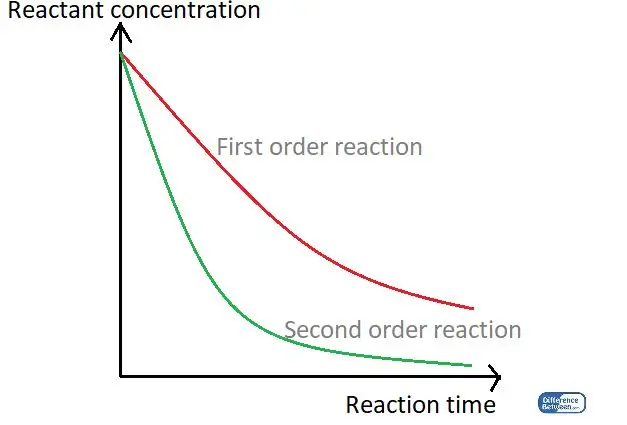
Rysunek 01: Wykres porównujący dwa rodzaje kolejności reakcji na podstawie ich czasu reakcji i stężenia reagenta.
Jeśli zwiększymy stężenie reagenta 2 razy (jeśli w równaniu szybkości są dwa reagenty), to szybkość reakcji wzrośnie 4 razy. Rozważmy na przykład następującą reakcję.
2A → P
Tutaj A jest reagentem, a P jest produktem. Jeśli jest to reakcja drugiego rzędu, równanie szybkości dla tej reakcji jest następujące.
Stawka=k[A]2
Ale dla reakcji z dwoma różnymi reagentami, jak poniżej;
A + B → P
Stawka=k[A]1[B]1
Jaka jest różnica między reakcjami pierwszego i drugiego rzędu?
Reakcje pierwszego rzędu to reakcje chemiczne, których szybkość zależy od stężenia molowego jednego z reagentów biorących udział w reakcji. Dlatego jeśli zwiększymy stężenie reagenta 2 razy, szybkość reakcji wzrośnie 2 razy. Reakcje drugiego rzędu to reakcje chemiczne, których szybkość zależy od stężenia molowego dwóch reagentów lub drugiej potęgi jednego reagenta biorącego udział w reakcji. Stąd, jeśli zwiększymy stężenie reagenta 2 razy, szybkość reakcji wzrośnie 4 razy. Poniższa infografika przedstawia różnicę między reakcjami pierwszego i drugiego rzędu w formie tabelarycznej.

Podsumowanie - reakcje pierwszego i drugiego rzędu
Istnieją trzy główne typy reakcji w zależności od kolejności reakcji; reakcje rzędu zerowego, pierwszego i drugiego rzędu. Kluczową różnicą między reakcjami pierwszego i drugiego rzędu jest to, że szybkość reakcji pierwszego rzędu zależy od pierwszej potęgi stężenia reagenta w równaniu szybkości, podczas gdy szybkość reakcji drugiego rzędu zależy od drugiej potęgi składnika stężenia w równanie szybkości.






