- Autor Alex Aldridge [email protected].
- Public 2023-12-17 13:47.
- Ostatnio zmodyfikowany 2025-06-01 07:37.
Kluczowa różnica - metan kontra etan
Metan i Etan to najmniejsi członkowie rodziny alkanów. Wzory cząsteczkowe tych dwóch związków organicznych to odpowiednio CH4 i C2H6. Kluczową różnicą między metanem a etanem jest ich budowa chemiczna; cząsteczkę etanu można uznać za dwie grupy metylowe połączone jako dimer grup metylowych. Inne różnice chemiczne i fizyczne wynikają głównie z tej różnicy strukturalnej.
Co to jest metan?
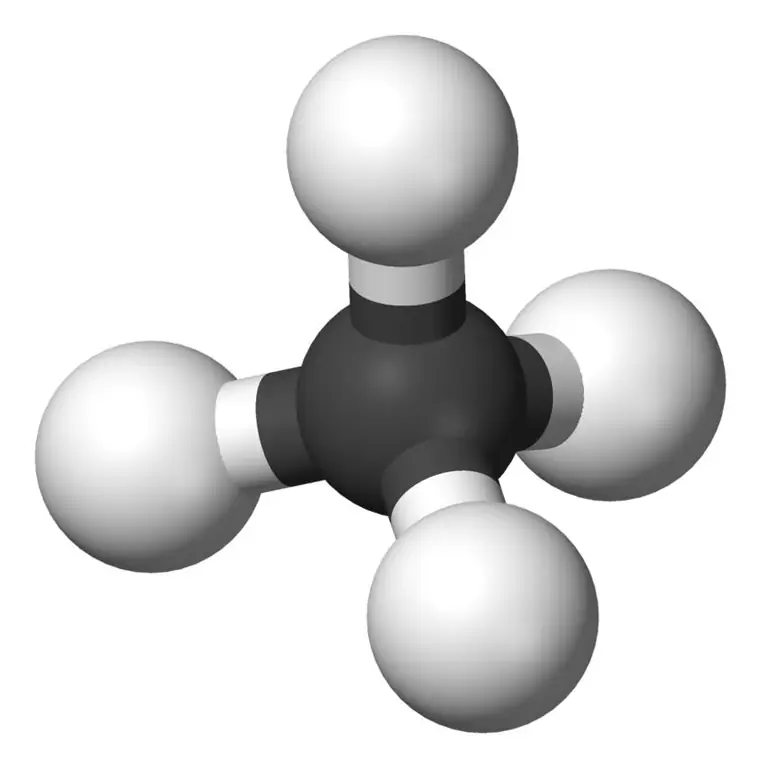
Metan jest najmniejszym członkiem rodziny alkanów o wzorze chemicznym CH4 (cztery atomy wodoru są związane z jednym atomem węgla). Uważany jest za główny składnik gazu ziemnego. Metan jest gazem bezbarwnym, bezwonnym i bez smaku; znany również jako karban, gaz bagienny, gaz ziemny, czterowodorek węgla i węglik wodoru. Łatwo się zapala, a jego opary są lżejsze od powietrza.
Metan naturalnie występuje pod ziemią i pod dnem morskim. Metan atmosferyczny jest uważany za gaz cieplarniany. Metan rozkłada się na CH3- z wodą w atmosferze.
Co to jest Etan?
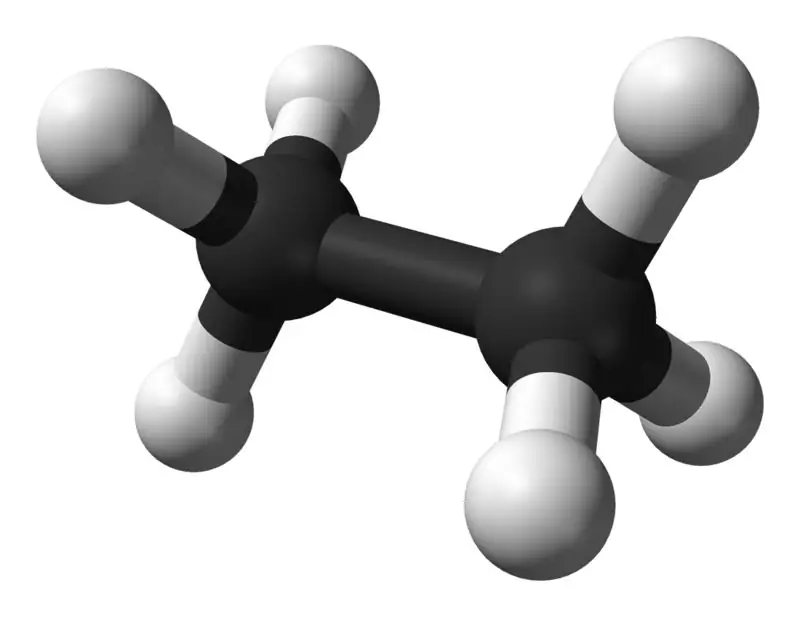
Etan to bezbarwny, bezwonny związek gazowy w standardowej temperaturze i ciśnieniu. Jego wzór cząsteczkowy i masa cząsteczkowa to odpowiednio C2H6 i 30,07 g·mol-1. Jest izolowany z gazu ziemnego, jako produkt uboczny procesu rafinacji ropy naftowej. Etan jest bardzo ważny w produkcji etylenu.
Jaka jest różnica między metanem a etanem?
Charakterystyka metanu i etanu
Struktura:
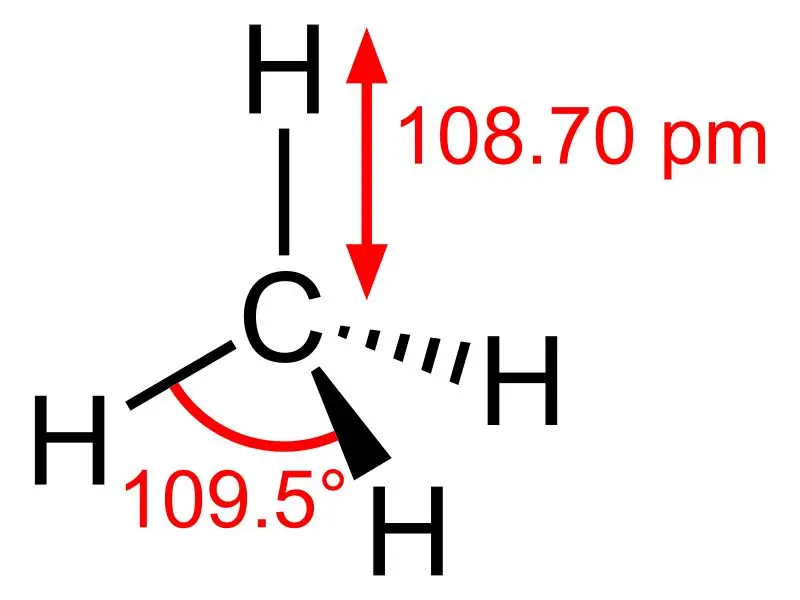
Metan: Wzór cząsteczkowy metanu to CH4, i jest to przykład tetraedrycznej cząsteczki z czterema równoważnymi wiązaniami C-H (wiązania sigma). Kąt wiązania między atomami H-C-H wynosi 109,50, a wszystkie wiązania C-H są równoważne i wynosi 108,70 pm.
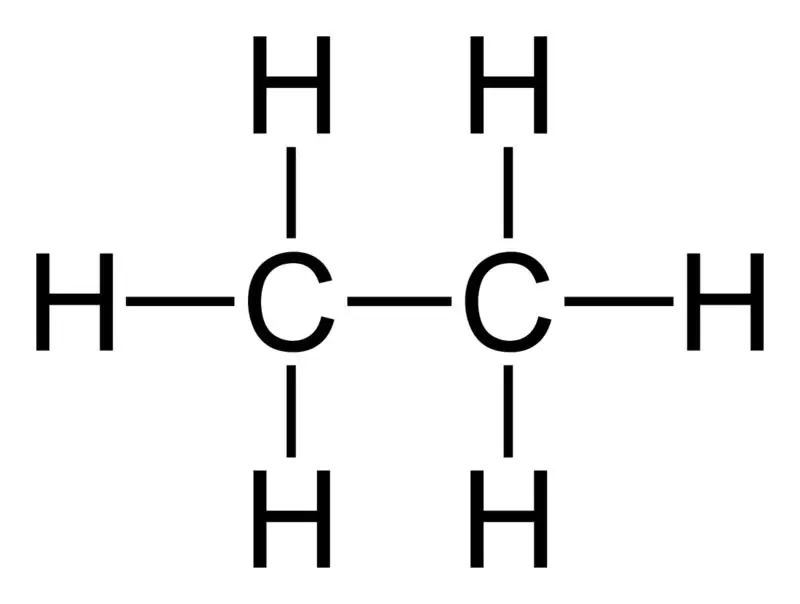
Etan: Wzór cząsteczkowy etanu to C2H6,i jest to węglowodór nasycony, ponieważ nie zawiera wiązań wielokrotnych.
Właściwości chemiczne:
Metan:
Stabilność: Metan jest chemicznie bardzo stabilną cząsteczką, która nie reaguje z KMnO4, K2Cr 2O7, H2SO4 lub HNO 3 w normalnych warunkach.
Spalanie: W obecności nadmiaru powietrza lub tlenu metan pali się jasnoniebieskim, nie świecącym płomieniem, wytwarzając dwutlenek węgla i wodę. Jest to reakcja silnie egzotermiczna; dlatego jest używany jako doskonałe paliwo. W obecności niewystarczającej ilości powietrza lub tlenu, spala się częściowo w gazowy tlenek węgla (CO).
Reakcje podstawienia: Metan wykazuje reakcje podstawienia z halogenami. W tych reakcjach jeden lub więcej atomów wodoru jest zastępowanych przez równą liczbę atomów halogenu i nazywa się to „halogenowaniem”.” Reaguje z chlorem (Cl) i bromem (Br) w obecności światła słonecznego.
Reakcja z parą wodną: Kiedy mieszanina metanu i pary przechodzi przez rozgrzany (1000 K) nikiel osadzony na powierzchni tlenku glinu, może wytworzyć wodór.
Piroliza: Gdy metan jest podgrzewany do około 1300 K, rozkłada się na sadzę i wodór.
Etan:
Reakcje: Etan (CH3CH3) reaguje z parami bromu w obecności światła tworząc bromoetan (CH 3CH2Br) i bromowodór (HBr). Jest to reakcja substytucji; atom wodoru w etanie jest zastąpiony atomem bromu.
CH3CH3 + Br2 à CH3 CH2Br + HBr
Spalanie: Całkowite spalanie etanu wytwarza 1559,7 kJ/mol (51,9 kJ/g) ciepła, dwutlenku węgla i wody.
2 C2H6 + 7 O2 → 4 CO 2 + 6 H2O + 3120 kJ
Może również wystąpić bez nadmiaru tlenu, tworząc mieszankę amorficznego węgla i tlenku węgla.
2 C2H6 + 3 O2 → 4 C + 6 H 2O + energia
2 C2H6 + 5 O2 → 4 CO + 6 H 2O + energia
2 C2H6 + 4 O2 → 2 C + 2 CO + 6 H2O + energia itp.
Definicje:
Reakcje podstawienia: Reakcja podstawienia to reakcja chemiczna, która polega na zastąpieniu jednej grupy funkcyjnej w związku chemicznym i zastąpieniu jej inną grupą funkcyjną.
Zastosowania:
Metan: Metan jest używany w wielu przemysłowych procesach chemicznych (jako paliwo, gaz ziemny, skroplony gaz ziemny) i jest transportowany jako płyn schłodzony.
Etan: Etan jest używany jako paliwo do silników i jako czynnik chłodniczy w systemach o bardzo niskich temperaturach. Jest dostarczany w stalowych butlach jako skroplony gaz pod własnym ciśnieniem pary.






