- Autor Alex Aldridge [email protected].
- Public 2023-12-17 13:47.
- Ostatnio zmodyfikowany 2025-06-01 07:37.
Kluczowa różnica między helisą alfa i beta polega na rodzaju wiązania wodorowego, jakie tworzą podczas tworzenia tych struktur. Alfa helisy tworzą wewnątrzcząsteczkowe wiązania wodorowe, podczas gdy beta helisy tworzą międzycząsteczkowe wiązania wodorowe.
Białka złożone mają cztery strukturalne poziomy organizacyjne - pierwszorzędowy, drugorzędowy, trzeciorzędowy i czwartorzędowy. Struktury drugorzędowe białek tworzą łańcuchy peptydowe w różnych orientacjach. Łańcuchy peptydowe składają się z sekwencji aminokwasowych połączonych wiązaniami peptydowymi. Dlatego w białkach istnieją dwie główne struktury drugorzędowe, takie jak alfa helisa i beta helisa. Ponadto istnieją inne struktury drugorzędowe zwane strukturami skrętu beta i spinki do włosów. Ten artykuł skupia się głównie na różnicy między helisą alfa i beta.
Co to jest Alpha Helix?
Białka mają cztery strukturalne poziomy organizacji. Spośród nich helisa alfa jest najczęstszą strukturą drugorzędową białek. I ta struktura wygląda jak pręt owinięty wokół centralnej osi. Co więcej, alfa helisa jest prawoskrętną helisą. Jednak helisy leworęczne również mogą być obecne. Tutaj wiązania peptydowe tworzą się od końca aminowego do końca karboksylowego. Aminokwasy łączą się ze sobą za pośrednictwem tych wiązań peptydowych. Wewnątrzcząsteczkowe wiązania wodorowe są główną przyczyną tworzenia helisy alfa.
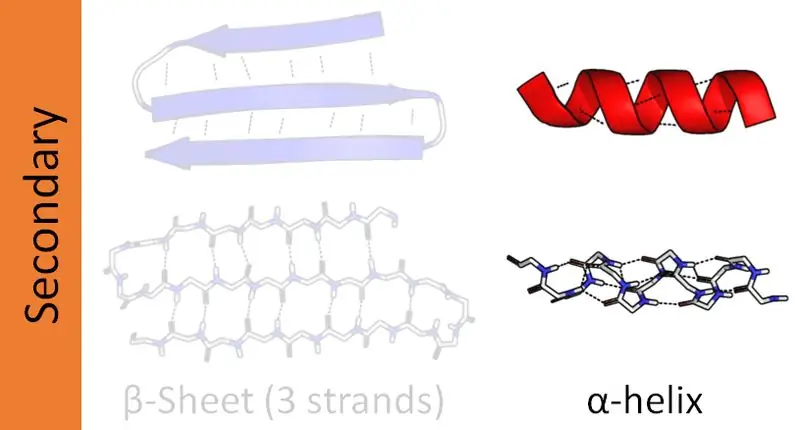
Rysunek 01: Alfa Helix
Układ alfa helisy zależy od hydrofilowej i hydrofobowej natury białka. Jeśli sekwencja aminokwasowa składa się z dużej liczby hydrofilowych grup R (zmiennych), grupy R orientują się w fazie wodnej. Jeśli zmienne grupy są hydrofobowe, będą wystawać do hydrofobowej fazy środowiska. W każdym scenariuszu grupy R wydają się wychodzić poza strukturę spiralną. Ze względu na te cechy strukturalne alfa helisa jest bardziej odporna na mutacje. Zatem obecność wiązań wodorowych stabilizuje strukturę alfa helisy. W alfa helisie występuje średnio 3,6 reszt na obrót, ponieważ do powstania wiązań wodorowych potrzeba 3,6 reszt. Niektóre białka strukturalne, takie jak kolagen i keratyna, są bogate w alfa helisy.
Co to jest Beta Helix?
Helisa beta jest drugą najczęstszą strukturą drugorzędową białka. Chociaż nie jest tak powszechna jak alfa helisa, obecność beta helis również odgrywa ważną rolę w strukturze białka. Tworzenie helisy beta odbywa się za pomocą dwóch arkuszy beta ułożonych w sposób równoległy lub antyrównoległy. Arkusze te następnie formują się w strukturę spiralną. Międzycząsteczkowe wiązania wodorowe między dwoma pasmami arkusza pomagają w tworzeniu helisy beta.

Rysunek 02: Beta Helix
Helisy beta mogą być zarówno praworęczne, jak i leworęczne, w zależności od ich schematu wiązania. Podczas tworzenia helisy beta, zmienne grupy dwóch arkuszy beta ułożą się w rdzeniu helisy. Dlatego większość grup tworzących arkusze beta ma funkcje hydrofobowe.
W przeciwieństwie do helisy alfa, 17 reszt tworzy jeden obrót w helisach beta. Jony metali mają zdolność aktywowania tworzenia helisy Beta. Podobnie jak w przypadku helisy alfa, wiązania wodorowe wspierają utrzymanie struktury helisy beta. Enzym anhydrazy węglanowej i liaza pektynowa to dwa białka bogate w beta helisy.
Jakie są podobieństwa między Alpha i Beta Helix?
- Alpha i Beta Helix to dwie drugorzędowe struktury białek.
- Aminokwasy są monomerami obu struktur drugorzędowych.
- Ponadto chemiczne składniki helis alfa i beta to węgiel, wodór, tlen, azot i siarka.
- Ponadto obie drugorzędne struktury rozwijają się w organizację wyższego poziomu.
- Ponadto oba są stabilizowane wiązaniami wodorowymi.
- W obu strukturach hydrofobowość jest określana przez obecność grup R aminokwasów.
Jaka jest różnica między alfa i beta helisą?
Kluczową różnicą między helisą alfa i beta jest rodzaj wiązania wodorowego, jaki wykazują. Alfa helisa wykazuje wewnątrzcząsteczkowe wiązania wodorowe, podczas gdy beta helisa wykazuje międzycząsteczkowe wiązania wodorowe. Ponadto, alfa helisa tworzy prawoskrętną helisę, podczas gdy beta helisa może tworzyć zarówno prawo, jak i lewoskrętne helisy. Jest to więc również znacząca różnica między helisą alfa i beta.
Ponadto, kolejna różnica między alfa i beta helisą polega na tym, że tworzenie alfa helisy odbywa się przez skręcenie sekwencji aminokwasowej, podczas gdy w przypadku beta helisy dwie harmonijki beta są połączone równolegle lub antyrównolegle do tworzą strukturę spiralną.
Poniższa grafika informacyjna przedstawia więcej informacji na temat różnicy między helisą alfa i beta.

Podsumowanie - Alfa kontra Beta Helix
Zarówno alfa helisy, jak i beta helisy są ważne w identyfikowaniu i dedukowaniu złożonych struktur białkowych. Oba typy są drugorzędowymi strukturami białek. Jednak alfa helisa jest spiralnym skrętem sekwencji aminokwasowych. W przeciwieństwie do tego, tworzenie helisy beta odbywa się poprzez wiązanie wodorowe równoległych lub antyrównoległych arkuszy beta. Ponadto wiązanie wodorowe jest wewnątrzcząsteczkowe w postaci alfa helisy, podczas gdy wiązanie wodorowe jest międzycząsteczkowe w postaci beta helisy. Poza tym obie te struktury posiadają grupę R, która decyduje o hydrofobowości białka. W ten sposób podsumowuje różnicę między helisą alfa i beta.






